
Thermisch verzinken
Het ABC van thermisch verzinken
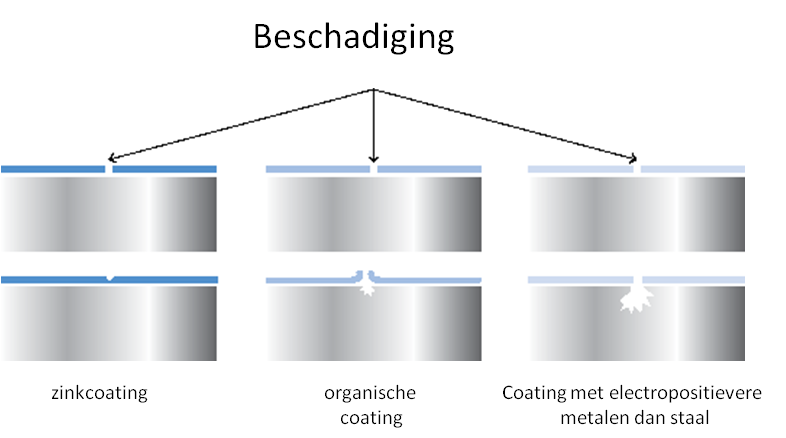
Als er een (kleine) beschadiging optreedt tijdens het gebruik van een thermisch verzinkt voorwerp, dan zal dit niet direct aanleiding geven voor rode ijzerroest. Hoe dat komt? In een vochtige omgeving (een zogenaamd elektrolyt) vormen zink en staal samen een galvanisch element waarvan het meer elektronegatieve zink (anode, dat in oplossing gaat) elektronen levert aan het staal (kathode). Dit laatste vrijwaart het voorwerp van corrosie (zie afbeelding). De zink-ionen die in oplossing gaan, verbinden zich met ionen in de atmosfeer (CO2, SO2, NOx) waarbij zich passiverende zinkzouten vormen die de beschadigde en daarmee onbedekte delen opvullen. Onder invloed van weer en wind zal echter steeds opnieuw een dergelijke laag opgebouwd moeten worden en dus zink in oplossing gaan. Afhankelijk van de grootte van de onverzinkte plek zal op een gegeven moment rode roest gaan optreden, terwijl het grootste deel van het voorwerp nog beschermd is door een zinklaag.
Soms spreekt men over een 'zelfherstellend effect van de zinklaag' als men kathodische eigenschappen wil benoemen. Feitelijk is het zelfherstellend effect, wat benaming betreft, onjuist. Er vindt immers geen herstel plaats.
De plaats van zink in de galvanische reeks
| ANODE (NEGATIEF) | |
| Magnesium | |
| Zink → | |
| Aluminium |
zink beschermt staal |
| Cadmium | |
| Staal ← | |
| Lood | |
| Tin | |
| Nikkel | |
| Messing | |
| Koper | |
| KATHODE POSITIEF | |

Het ABC van thermisch verzinken